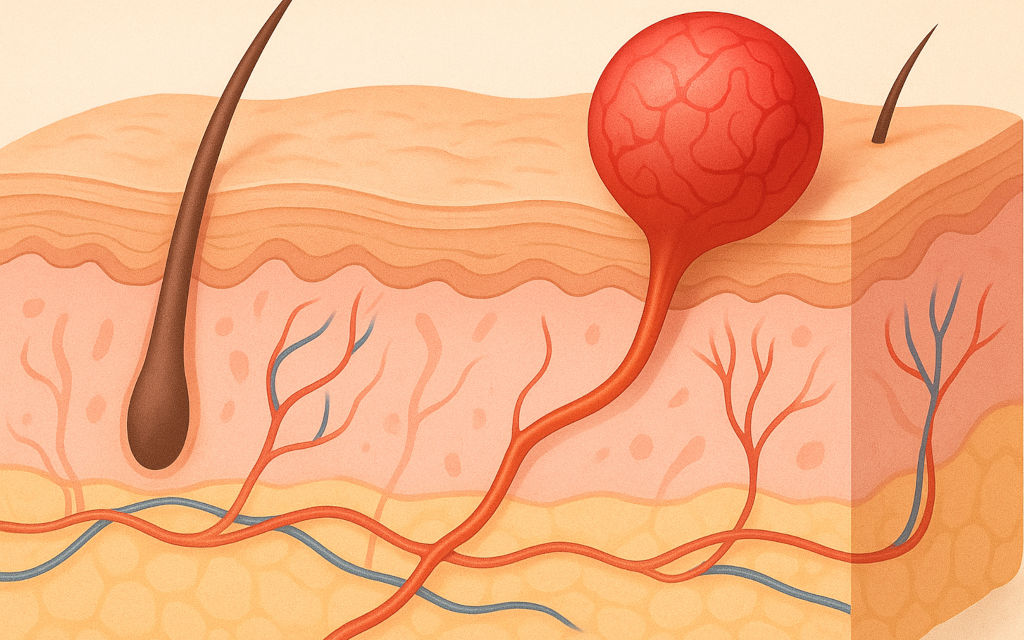
Durerea este una dintre cele mai fundamentale experiențe senzoriale ale ființei umane. Ea are o funcție biologică esențială, acționând ca un sistem de avertizare care semnalează prezența unei leziuni tisulare sau a unei amenințări pentru integritatea organismului. În centrul acestui mecanism complex se află nociceptorii – receptori specializați ai sistemului nervos periferic care detectează stimuli potențial nocivi și inițiază procesul neurofiziologic al durerii.
Studiul nociceptorilor și al modului în care aceștia transformă stimulii fizici și chimici în semnale neuronale a deschis calea către înțelegerea durerii acute și cronice, precum și către dezvoltarea tratamentelor moderne pentru controlul durerii.
Originea și natura nociceptorilor
Termenul de nociceptor* provine din latinescul nocere, care înseamnă „a vătăma” sau „a face rău”. Acești receptori senzoriali sunt terminații nervoase libere, neînvelite de structuri specializate, răspândite în întreg corpul – în piele, mușchi, articulații, oase și organele interne.
Spre deosebire de alți receptori somatosenzoriali, cum ar fi cei pentru atingere sau temperatură moderată, nociceptorii sunt adaptați pentru a răspunde la stimuli extremi, capabili să producă leziuni tisulare: presiune mecanică intensă, temperaturi foarte ridicate sau scăzute, substanțe chimice iritante și inflamații.
Din punct de vedere funcțional, nociceptorii pot fi împărțiți în mai multe categorii: mecanociceptori, care răspund la stimuli mecanici puternici (precum ciupiturile sau presiunea excesivă), termociceptori, sensibili la temperaturi extreme, și nociceptori polimodali, care reacționează la o combinație de stimuli mecanici, termici și chimici. Există, de asemenea, nociceptori silențioși care nu răspund în mod normal la stimuli nocivi, dar devin activi în condiții de inflamație sau leziune tisulară.
Transducția și transmiterea semnalului nociceptiv
Procesul prin care nociceptorii detectează și transformă stimulii nocivi în semnale electrice se numește transducție. Atunci când un nociceptor este activat, membrana sa neuronală suferă modificări ionice care duc la generarea unui potențial de acțiune. Acest semnal electric este apoi transmis către măduva spinării prin fibre nervoase de calibru mic, în special fibrele Aδ și fibrele C.
Fibrele Aδ sunt mielinizate, ceea ce le permite să conducă impulsurile rapid (5–30 m/s), fiind responsabile pentru durerea acută, ascuțită și bine localizată. Fibrele C, nemielinizate și mai lente (0,5–2 m/s), transmit durerea difuză, arzătoare, persistentă – asociată adesea cu inflamația. În măduva spinării, aceste semnale ajung în cornul posterior, unde se conectează cu interneuroni și neuroni de proiecție care trimit informația către creier, în special către talamus și cortexul somatosenzorial.
Integrarea și percepția durerii
Durerea nu este doar un fenomen periferic, ci și un construct al sistemului nervos central. Odată ce impulsurile nociceptive ajung la creier, ele sunt procesate în mai multe regiuni interconectate, formând ceea ce se numește matricea durerii. Aceasta include talamusul (care acționează ca un centru de releu senzorial), cortexul somatosenzorial (responsabil pentru localizarea și intensitatea durerii), sistemul limbic (implicat în componenta emoțională) și cortexul prefrontal (implicat în evaluarea cognitivă a durerii).
Astfel, percepția durerii este o experiență multidimensională, care combină aspecte senzoriale, emoționale și cognitive. Acesta este motivul pentru care durerea nu este întotdeauna proporțională cu gradul leziunii fizice – factori precum stresul, anxietatea sau contextul social pot amplifica sau diminua percepția durerii.
Plasticitatea nociceptivă și sensibilizarea
Un aspect crucial al nocicepției este plasticitatea acestuia, adică abilitatea sistemului nervos de a-și modifica răspunsurile în timp. După o leziune sau o inflamație, nociceptorii pot deveni hipersensibili, un fenomen cunoscut sub numele de sensibilizare periferică. În acest caz, pragul de activare al receptorilor scade, iar stimuli anterior inofensivi pot fi percepuți ca dureroși (alodinie).
În paralel, la nivelul măduvei spinării și al creierului poate apărea sensibilizarea centrală, un proces prin care circuitele neuronale amplifică semnalele nociceptive. Aceste mecanisme sunt implicate în dezvoltarea durerii cronice, în care durerea persistă mult timp după vindecarea leziunii inițiale. Astfel, nociceptorii, deși esențiali pentru protecția organismului, pot contribui și la stări patologice atunci când sistemul de procesare a durerii devine dereglat.
Mediatorii chimici ai nocicepției
La nivel molecular, activitatea nociceptorilor este reglată de o varietate de mediatori chimici. În urma unei leziuni tisulare, celulele eliberează substanțe precum bradikinina, histamina, prostaglandinele și ATP-ul, care acționează asupra receptorilor specifici de pe terminațiile nociceptive, intensificând semnalul de durere. De asemenea, nociceptorii pot elibera neuropeptide, cum ar fi substanța P și peptida legată de gena calcitoninei (CGRP), care contribuie la inflamația locală și la sensibilizarea ulterioară.
Un rol deosebit îl au și canalele ionice din membrana nociceptorilor, cum ar fi TRPV1, sensibil la temperaturi ridicate și capsaicină (componenta activă din ardeiul iute), sau ASICs (canalele activate de aciditate), care răspund la modificările de pH din țesuturile inflamate. Aceste structuri moleculare reprezintă ținte importante pentru dezvoltarea medicamentelor analgezice moderne.
Nociceptorii și durerea viscerală
Un domeniu de mare interes științific este studiul nocicepției viscerale – durerea provenită din organele interne. Spre deosebire de durerea somatică, durerea viscerală este adesea difuză, greu de localizat și însoțită de reacții vegetative (greață, transpirație, tahicardie). Aceasta se datorează faptului că nociceptorii viscerali au o densitate mai mică și fac sinapse cu neuroni spinali care primesc și informații somatice, fenomen care explică durerea proiectată – de exemplu, durerea de umăr resimțită în timpul unui infarct miocardic.
Implicații clinice și terapeutice
Înțelegerea profundă a nociceptorilor are implicații clinice majore. Numeroase afecțiuni – de la artrită și neuropatii periferice, până la migrene și dureri postoperatorii – implică disfuncții ale sistemului nociceptiv. Astfel, cercetarea actuală se concentrează pe identificarea și blocarea mecanismelor moleculare care duc la activarea excesivă a acestor receptori.
Printre strategiile terapeutice moderne se numără utilizarea antagoniștilor canalelor TRPV1, a blocanților de sodiu specifici pentru fibrele C, precum și terapiile genetice menite să reducă expresia receptorilor implicați în sensibilizarea dureroasă. În paralel, abordările non-farmacologice – cum ar fi stimularea electrică nervoasă transcutanată (TENS), acupunctura sau terapia cognitiv-comportamentală – vizează modularea percepției durerii la nivel central.