Cancerele se răspândesc în corp precum termitele într-o casă. Adesea, o tumoare apare într-o parte a corpului, ca de exemplu pancreasul. Cu toate acestea, în multe cazuri, unele celule se desprind și călătoresc prin fluxul sanguin către noi părți ale corpului, cum ar fi ficatul sau plămânii. Acest proces, numit metastază, este responsabil pentru peste 90% din decesele legate de cancer.
Metastaza se desfășoară în mai multe etape. Mai întâi se instalează o invazie locală, prin care celulele canceroase se răspândesc în țesuturile din vecinătate. Apoi câteva celule se desprind din tumoarea principală și pătrund în vasele de sânge din apropiere (intravazare), de unde pot fi transportate în orice parte a corpului. În cele din urmă, câteva celule canceroase ies din fluxul sanguin și încearcă să se stabilească într-un nou organ, crescând și formând o nouă tumoare (colonizare).
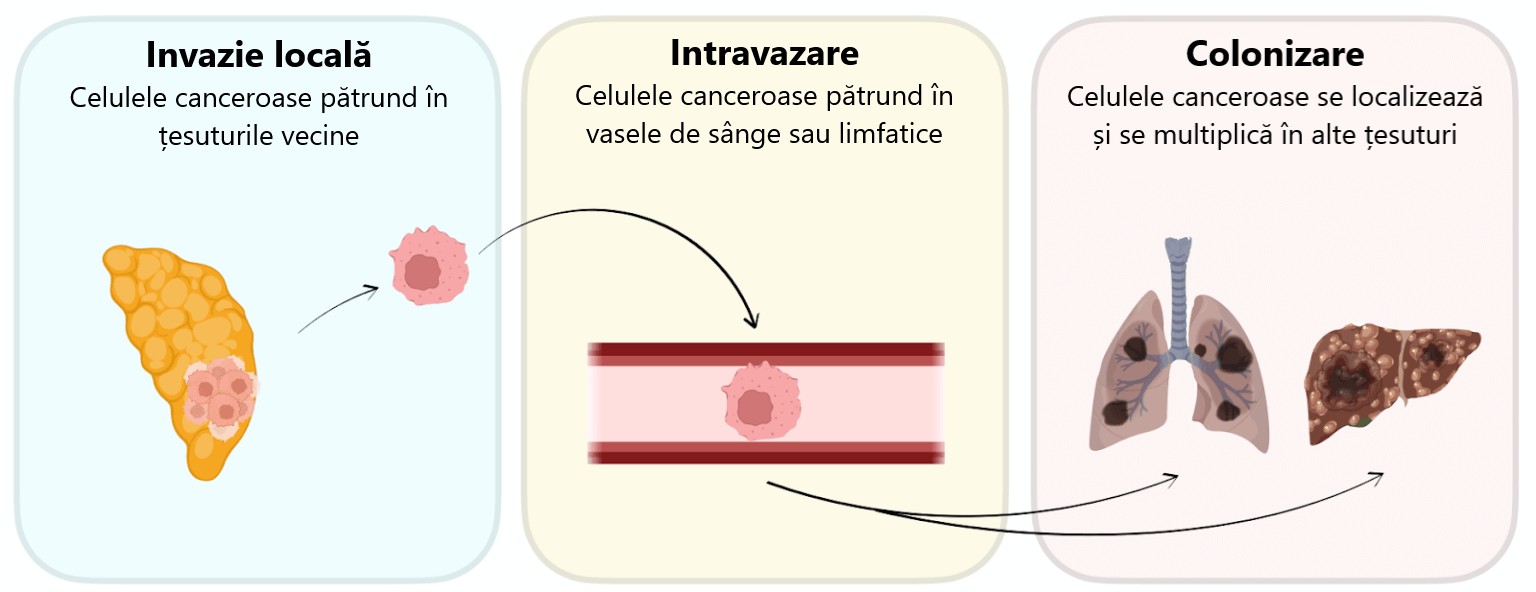
Cancerul se răspândește printr-un proces în mai multe etape: (1) invazie locală în țesutul înconjurător, (2) intravazare în vasele de sânge din apropiere, urmată de călătorie prin fluxul sanguin și extravazare într-un organ nou și (3) colonizare, unde cancerul trebuie să crească cu succes într-un mediu nou. Colonizarea este adesea cea mai dificilă și mai puțin înțeleasă etapă.
Colonizarea este adesea cea mai dificilă etapă pentru celulele canceroase, deoarece acestea nu pot crește în organe care nu au condițiile potrivite. De exemplu, organele pot să nu aibă nutrienții potriviți sau sistemul imunitar poate fi prea ostil. Oamenii de știință descriu adesea acest lucru folosind o teorie cunoscută sub numele de ipoteza „sămânței și solului”, care datează din anii 1800. Potrivit acestei teorii, celula canceroasă este sămânța, iar organul în care ea ajunge este solul. La fel ca o sămânță, o celulă canceroasă poate crește doar dacă ajunge într-un sol cu nutrienții și condițiile potrivite.
Casă, dulce casă!
Cercetătorii au petrecut decenii studiind modul în care celulele canceroase se adaptează și evoluează pentru a supraviețui în medii noi. Cu toate acestea, o întrebare rămâne în mare parte fără răspuns: odată ce o celulă canceroasă s-a stabilit într-un nou organ, ea se schimbă? Sau se comportă în continuare ca și cum ar aparține locului său original? Cu alte cuvinte, dacă o celulă canceroasă pancreatică ajunge în ficat, ea începe să se comporte ca o celulă canceroasă hepatică sau continuă să se comporte ca una pancreatică?
Aceasta este întrebarea la care o echipă de la Institutul Koch pentru Cercetare Integrativă a Cancerului din cadrul MIT și-a propus să răspundă. Cercetătorii au folosit un model murin bine stabilit de adenocarcinom ductal pancreatic, unul dintre cele mai mortale tipuri de cancer. Au izolat celule canceroase din trei locuri diferite: tumori primare din pancreas (pentru a înțelege celulele canceroase în mediul lor natural) și celule canceroase originare din pancreas care au metastazat fie în ficat, fie în plămâni (pentru a înțelege cum se pot adapta celulele canceroase la un nou mediu).
Echipa a reimplantat apoi aceste celule în șoareci sănătoși, plasându-le fie în pancreas, fie în ficat, fie într-un loc neutru „de flanc” (chiar sub piele, fără legături speciale cu vreun organ). Logica era simplă: dacă celulele metastatice originare din pancreas s-au adaptat la noile lor locuri, atunci celulele derivate din ficat ar trebui să crească mai bine în ficat, iar celulele derivate din plămâni ar trebui să crească mai bine în plămâni. Dacă originea lor încă le dicta comportamentul, atunci ar trebui să crească cel mai bine în pancreas, indiferent unde au metastazat.
Cercetătorii au descoperit ultima variantă: celulele canceroase pancreatice, fie că proveneau dintr-o tumoare primară, fie dintr-o metastază hepatică sau pulmonară, au crescut semnificativ mai bine în pancreas decât în ficat sau sub piele. Tumorile din pancreas au fost de până la patru ori mai mari, au prezentat o creștere celulară mai rapidă și au avut rate de moarte celulară mai mici decât aceleași celule plasate în ficat sau pe flanc. În mod surprinzător, chiar și după ce au supraviețuit într-un mediu nou, celulele canceroase s-au comportat ca și cum nu și-ar fi părăsit niciodată locuința (pancreasul).
Păstrarea unei părți a identității originale
De ce o celulă canceroasă care a trăit deja într-un organ nou se dezvoltă cel mai bine în cel vechi? Ce o împiedica să se adapteze complet? Cercetătorii bănuiau că răspunsul avea legătură cu modul în care celulele canceroase consumă și procesează nutrienții – cu alte cuvinte, cu metabolismul lor.
Deoarece fiecare organ din corp are disponibil un amestec diferit de nutrienți, celulele canceroase care se formează în organe diferite învață să se bazeze pe surse diferite de combustibil. De exemplu, celulele canceroase care cresc în pancreas depind de obicei de glucoză și glutamină, în timp ce celulele canceroase care cresc în ficat utilizează adesea mai multe grăsimi și alți aminoacizi. Așadar, dacă o celulă canceroasă pancreatică s-ar muta în ficat și s-ar adapta cu adevărat la noul său mediu, ne-am aștepta să înceapă să utilizeze mai multe grăsimi și alți aminoacizi, la fel ca tumorile hepatice.
Dar nu asta s-a întâmplat. Chiar și după ce celulele canceroase pancreatice s-au răspândit în ficat, acestea au continuat să utilizeze glucoză și glutamină în același mod în care o făceau în pancreas. Nu au trecut la tipurile de nutrienți pe care le preferă celulele canceroase hepatice. Acest lucru a arătat că metabolismul lor era încă modelat de organul din care proveneau, nu de cel în care se mutaseră.
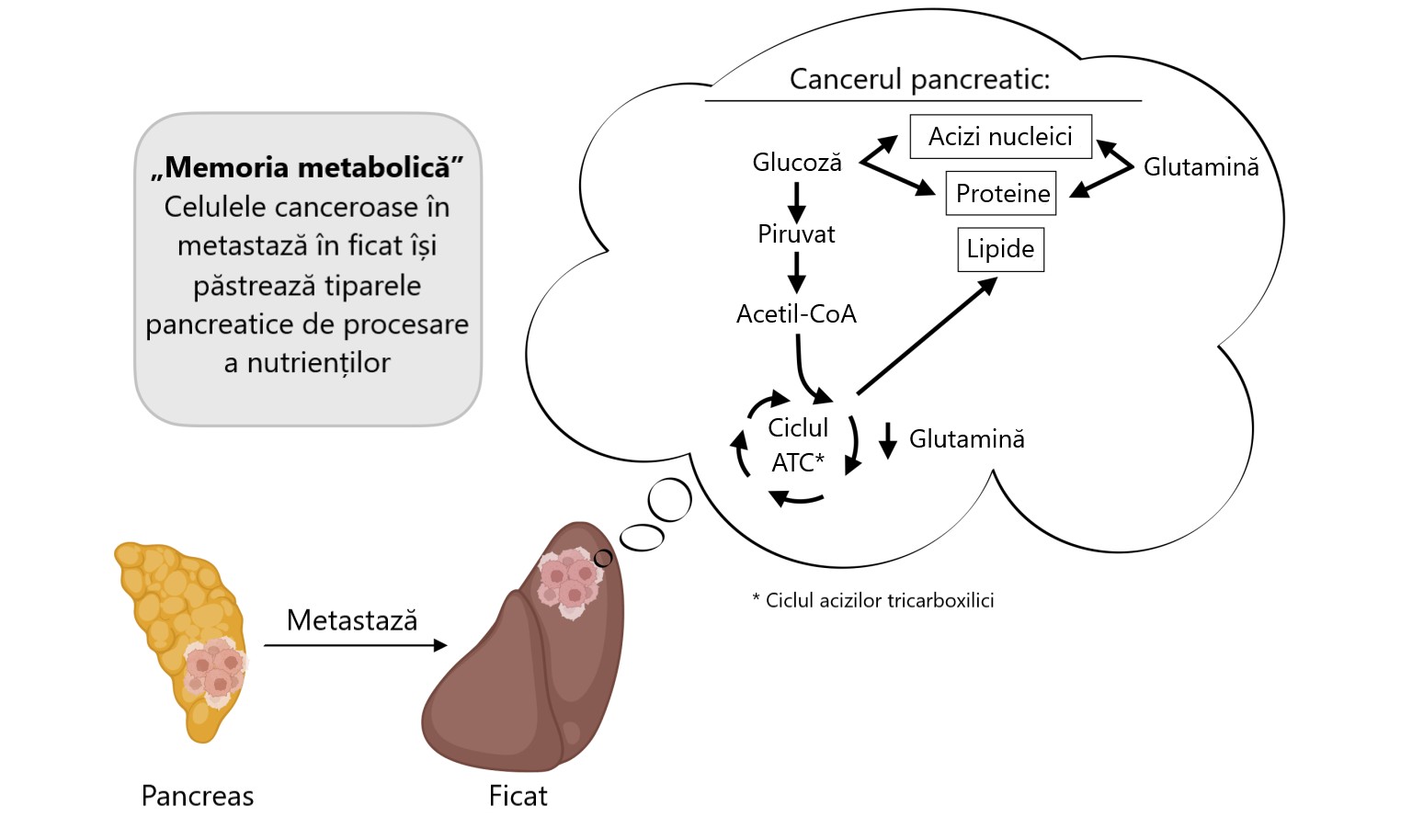
Celulele canceroase poartă o „memorie metabolică” a locului de unde provin. Chiar și după ce celulele canceroase pancreatice s-au răspândit în ficat, acestea au continuat să utilizeze glucoza și glutamina așa cum o făceau în pancreas. Acest lucru sugerează că celulele canceroase metastatice păstrează tiparele de procesare a nutrienților din țesutul lor de origine, în loc să se adapteze la mediul noului lor organ.
Poate părea un detaliu minor, dar are implicații majore. Dacă celulele canceroase metastatice continuă să se bazeze pe același combustibil pe care l-au folosit în organul lor original, acest lucru le face mai previzibile – și potențial mai vulnerabile. Aceasta înseamnă că tratamentele concepute pentru tumoarea originală ar putea funcționa în continuare, chiar și după ce cancerul s-a răspândit. În loc să avem nevoie de un plan complet nou pentru fiecare loc nou, am putea fi capabili să abordăm aceeași vulnerabilitate iar și iar.
Pentru a se asigura că acesta nu era doar un efect pe termen scurt, oamenii de știință au dus experimentul mai departe. Mai întâi, au permis celulelor canceroase pancreatice să crească în ficatul sau plămânul unui șoarece. Apoi, au luat aceleași celule canceroase și le-au transplantat în ficatul sau plămânul unui al doilea șoarece. Au repetat acest proces timp de până la opt runde, de fiecare dată folosind celule de la șoarecele anterior. Acest lucru a permis celulelor canceroase să trăiască într-un nou mediu organic timp de luni de zile, oferindu-le multe șanse de a se adapta și de a-și schimba metabolismul. Dar chiar și după toate acele generații de creștere într-un nou organ, când celulele au fost în sfârșit plasate înapoi în pancreas, acestea au crescut tot mai bine acolo decât oriunde altundeva. Metabolismul lor de bază nu se schimbase.
În cele din urmă, pentru a confirma că acest lucru nu era specific cancerului pancreatic, cercetătorii au efectuat experimente similare folosind cancer pulmonar și cancer hepatic. Aceeași tendință a rămas – celulele canceroase pulmonare au crescut cel mai bine în plămâni, iar celulele canceroase hepatice au crescut cel mai bine în ficat. Fiecare tip de cancer părea legat metabolic de țesutul său de origine.
Noi perspective pentru tratamentul cancerului
Timp de decenii, o mare parte din cercetarea cancerului s-a concentrat pe capacitatea remarcabilă a celulelor canceroase de a se adapta, evolua și supraviețui în teritorii nefamiliare. Însă acest studiu contestă această presupunere. Se pare că multe celule canceroase nu se adaptează complet. Ele își aduc cu ele nevoile și comportamentele inițiale. Ajung la organe noi cu un metabolism oarecum inflexibil, iar atunci când amestecul ideal de nutrienți pe care l-au consumat în organul de origine nu este disponibil, creșterea lor este limitată.
Aceasta nu este doar o ciudățenie biologică interesantă, ci și o potențială slăbiciune. Dacă metastazele păstrează aceleași dependențe metabolice ca și tumoarea primară, atunci tratamentele care vizează aceste trăsături metabolice ar putea funcționa în întregul corp. De exemplu, se știe că tumorile pancreatice se bazează în mare măsură pe metabolismul glutaminei, iar în prezent sunt testate mai multe medicamente pentru a bloca această cale, cum ar fi CB-839 (cunoscut și sub numele de telaglenastat), un inhibitor al glutaminazei. Dacă celulele canceroase pancreatice metastatice încă depind de glutamină chiar și după răspândire, atunci un medicament ca acesta ar putea rămâne eficient indiferent de locul în care s-a mutat cancerul pancreatic în organism.
Privind în perspectivă, această cercetare sugerează un nou mod de gândire. În loc să urmărim doar locurile în care se răspândește cancerul, am putea începe să ne întrebăm cum se comportă și dacă încă respectă regulile originii sale. Dacă putem cartografia care tipuri de cancer sunt inflexibile din punct de vedere metabolic, am putea într-o zi să învățăm cum să le întrerupem alimentarea cu combustibil sau să proiectăm tratamente care să le împingă în medii în care pur și simplu nu pot crește. La urma urmei, chiar și termitele care ajung la baie sau la subsol încă tânjesc după lemnul pe care l-au mestecat în garaj. Se pare că celulele canceroase nu sunt atât de diferite.
